|
|
|
Влияние условий культивирования на ультраструктуру зеленой водоросли Trebouxia, фикобионта лишайника Hypogymnia physodes.
Власова Т.А., Жевлачкова И.К. Tatyana A. Vlasova, Irina K. Zhevlachkova
Московский
Государственный Университет им. М. В. Ломоносова,
УДК 57.086.3+576.31+582.29+58.02
Зеленую водоросль Trebouxia, фикобионт эпифитного листоватого лишайника Hypogymnia physodes, выделенную из лишайника, культивировали на средах различного состава и в различных условиях освещения. Ультраструктура водоросли значительно варьировала в зависимости от условий. Наибольшее сходство с фикобионтом в составе таллома лишайника проявляла автотрофная культура водоросли. Вероятно, большинство изменений имеют адаптивный характер. Ключевые слова: лишайники; фикобионты; Hypogymnia physodes; Trebouxia; электронная микроскопия; ультраструктура; адаптация.
Введение Характер взаимоотношений фикобионта и микобионта является одним из наиболее интенсивно изучаемых, но, тем не менее, недостаточно изученных вопросов физиологии лишайников. Этот характер может существенно изменяться у одного и того же вида под влиянием разных факторов. Фикобионт и микобионт могут быть выделены в чистые культуры, то есть способны к полной делихенизации. Вследствие изоляции их обмен веществ быстро и заметно изменяется (Green, Smith, 1974; Вайнштейн, Тахтаджян, 1981 и др.). Но при этом симбионты не теряют свойства вновь объединяться, то есть делихенизация в этом случае обратима (Miao et al.,1997; Stocker-Wörgötter, Türk, 1989; Лобакова, Смирнов, 2008). Иной характер носит частичная делихенизация, вызванная действием неблагоприятных факторов, нарушающих взаимосвязь симбионтов и их деградацию до некоторой степени. Она также обратима до определенных пределов. Но если при этом деградация становится слишком значительной, такой процесс может привести к гибели части таллома или всего организма (Плакунова, Власова, 1985). Способность к делихенизации демонстрирует лабильность взаимоотношений фикобионта и микобионта. При определении некоторых метаболических процессов в целых лишайниках также обнаружены колебания, в частности, сезонные (Равинская, 1975; Hale, 1983; Kershaw, 1984; Брунь, 1991 и др.). Для уточнения пределов лабильности функций симбионтов представляется целесообразным изучение их метаболизма в делихенизированном, то есть в изолированном состоянии. Изолированные культуры компонентов выделены из ряда лишайников и применяются в экспериментальной лихенологии для последующего ресинтеза или конструирования искусственных ассоциаций, а также для изучения возможности получения биологически активных веществ (Brunauer, Stocker-Wörgötter, 2005; Лобакова, Смирнов, 2008). Согласно данным литературы, лихенизация вызывает морфологические изменения фотобионтов, но не приводит к принципиальным изменениям их ультраструктуры, характерной для их систематических групп (Archibald, 1975; König, Peveling, 1984; Brunner , Honegger, 1985; Ascaso et al.,1995; Войцехович и др., 2011). Однако с изменением характера метаболизма клетки, как известно, детали ее ультраструктурной организации изменяются в определенных пределах. Поэтому по особенностям ультраструктуры клетки можно определить основную направленность ее обмена веществ. Целью настоящей работы являлось изучение влияния различающихся условий питания и освещения на ультраструктуру зеленой одноклеточной водоросли Trebouxia, фикобионта эпифитного листоватого лишайника Hypogymnia physodes (L.) Nyl. Водоросли рода Trebouxia de Puymaly (Trebouxiophyceae, Chlorococcales) являются наиболее часто встречающимися фикобионтами: по оценкам разных специалистов, от 20 до 50% всех известных лишайников содержат именно Trebouxia в качестве водорослевого симбионта, (Ahmadjian, 1973, Войцехович и др., 2011). Фотобионт лишайника H.physodes относят к виду Trebouxia jamesii (Friedl, Büdel, 1996; Ahmadjian, 1993). Материалы и методы Талломы лишайника Hypogymnia physodes собирали в лесу в окрестностях Беломорской биостанции МГУ на Кольском полуострове. Культура водоросли Trebouxia, выделенной из талломов лишайника H. physodes, была получена из лаборатории лихенологии Ботанического института им. В.Л. Комарова РАН. Водоросль выращивали на средах следующего состава: Среда 1 (в г/л): KNO3 – 1; K2HPO4 – 0,2; MgSO4 – 0,2; CaCl2 – 0,15. В среду 2 дополнительно к солям добавляли 10 г/л глюкозы. В среду 3 дополнительно к солям добавляли 10 г/л глюкозы, 10 г/л пептона и 1 г/л дрожжевого экстракта. Все среды готовились на водопроводной воде, и в них вносили смесь основных микроэлементов (в г/л): FeCl3 × 6H2O – 0,4; MnCl2 × 4H2O – 01; (NH4)4Mo7O4 – 0,1; H3BO3 – 0,1; CuSO4 × 5H2O – 0,01; ZnSO4 × 7H2O – 0,01; Co(NO3)2 × H2O – 0,01 ). Культуры инкубировали в колбах с 50 или 100 мл среды на круговой качалке при 30° С, скорости качания 100 об/мин и освещенности 1000 лк. Культуру на среде 3 выращивали параллельно и на свету, и в темноте. Материал исследовали методом трансмиссионной электронной микроскопии. Для изучения ультраструктуры лишайника брали из средней части таллома кусочки размером приблизительно 1 мм2. Культуры водоросли отфильтровывали, смешивали с 2%-ным теплым агаром и после застывания агар, содержащий водоросли, нарезали на кусочки приблизительно 1 мм3, которые и помещали в фиксатор. Материал фиксировали 2,5%-ным раствором глутарового альдегида в фосфатном буфере pH 7,4, постфиксировали 1%-ным раствором OsO4 в том же буфере, обезвоживали проведением через ряд растворов этанола возрастающей концентрации, причем в 70 %-ный раствор этанола добавляли уранилацетат (2%), и заливали в аралдит. Срезы изготавливали на ультратоме LKB-4800, контрастировали цитратом свинца (Reynolds, 1963) и просматривали в электронных микроскопах Hitachi HU-11F и Hitachi HB-1. Результаты и обсуждение Электронно-микроскопическое исследование выявило определенную вариабельность клеточной ультраструктуры водоросли в зависимости от условий культивирования. Строение типичной клетки Trebouxia в составе таллома H. physodes, то есть в лихенизированном состоянии, представлено на рис. 1.
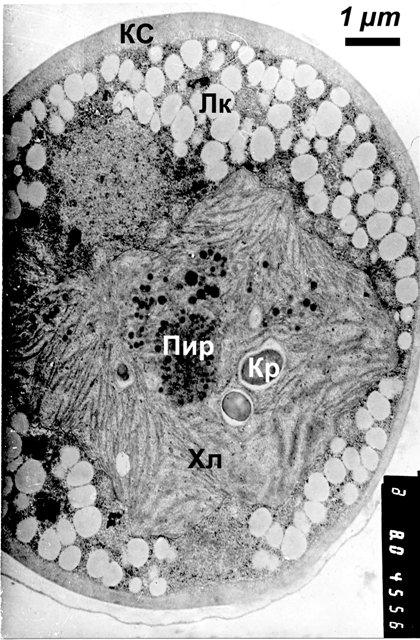
Рис.1. Ультраструктура клетки Trebouxia в талломе лишайника Hypogymnia physodes Кс - клеточная стенка, Лк - липидная капля, Пир - пиреноид, Кр - крахмальное зерно, Хл - хлоропласт
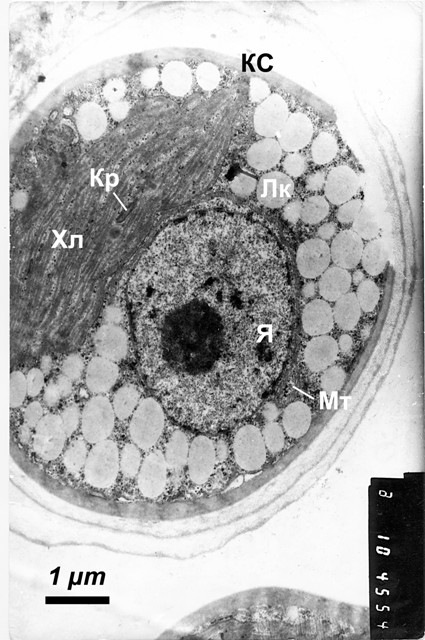
Клетки Trebouxia в талломе лишайника имеют округлую или неправильно-округлую форму. В клеточной стенке различаются три слоя. Все слои имеют зернисто-фибриллярную структуру, но различную электронную плотность: плотный узкий наружный слой, более широкий средний слой с малой плотностью и плотный широкий внутренний слой. Плазмалемма слабо извилиста и на большем протяжении плотно прилегает к клеточной стенке, на небольших участках образуя периплазматические пространства, а местами — инвагинации в клеточную стенку. Цитоплазма имеет среднюю плотность, в ней наблюдаются многочисленные рибосомы и немногочисленные профили эндоплазматического ретикулума и диктиосомы аппарата Гольджи. Большая часть объема клетки занята крупным центральным хлоропластом. Хлоропласт асимметричен, лопастной формы, тилакоиды в нем собраны в малоразветвленные пучки по 2-4 тилакоида. Расстояния между пучками довольно невелики, и в некоторых из них наблюдаются мелкие крахмальные зерна. Пластоглобулы немногочисленны, они имеют неравномерную электронную плотность, более высокую в центре и убывающую к периферии. При ультраструктурном исследовании хлоропластов Trebouxia большое значение у придается строению пиреноидов. Род Trebouxia был разделен на виды прежде всего на основании морфологии хлоропластов и особенно пиреноидов (Friedl, Büdel, 1996; Ahmadjian, 1993). В данном случае пиреноид имеет округло-продолговатую форму, мембраны по его границе не обнаруживается. Пиреноглобулы в нем в основном распределены по всему объему, иногда несколько больше по периферии, и электронная плотность их в среднем выше, чем у пластоглобул. У пиреноида не имеется крахмальной обкладки, то есть скопления крахмальных зерен снаружи от пиреноида по его границе, хотя у большинства видов Trebouxia такая обкладка присутствует, как и у ряда других одноклеточных зеленых водорослей (Friedl, Büdel, 1996; Болдина, 2008). Ядро клетки довольно крупное относительно размера клетки, овальной формы, хорошо просматривается двухслойная ядерная оболочка. Заметно выделяется ядрышко; хроматин в ядре частично диффузный, частично конденсированный, распределенный небольшими скоплениями по объему ядра, преимущественно вдоль ядерной оболочки. Митохондрии сравнительно немногочисленны, распределены по всему объему цитоплазмы. Они представлены преимущественно ортодоксальной конформацией, то есть имеют матрикс средней плотности и в основном пластинчатые кристы с несколько размытыми границами. Но часть митохондрий имеют более плотный матрикс и могут быть отнесены к промежуточным между ортодоксальными и конденсированными. Органеллы имеют небольшие размеры и овальную форму на срезе, внешняя мембрана иногда извилиста. Вакуолизирована клетка слабо, вакуолей мало и они невелики по размеру, часто содержат диффузный материал, иногда и электронно-плотные включения различной величины и формы. Некоторые из включений можно идентифицировать как полифосфатные гранулы; местами в вакуолях наблюдаются везикулы, различающиеся по величины и плотности. Большую часть объема цитоплазмы занимают небольшие, но многочисленные липидные включения с низкой электронной плотностью. В целом ультраструктура клеток фотобионта соответствует описаниям Trebouxia из H. physodes и других лишайников (Ascaso, 1978; Peveling, König, 1985; Gärtner, Ingoliċ, 1988; Ahmadjian,1993 и др.). При культивировании в условиях автотрофного, миксотрофного и гетеротрофного питания клетки водорослей Trebouxia претерпевают более или менее существенные ультраструктурные изменения по сравнению с клетками в составе таллома. Наиболее заметны изменения структуры хлоропластов, а также варьирование накоплений запасных веществ внутри клеток. В условиях фотоавтотрофного питания, на минеральной среде 1 при освещении, ультраструктура водоросли Trebouxia проявляет большое сходство с таковой у фикобионта в талломе лишайника (рис.2). Клеточная стенка у многих клеток несколько толще, чем у лихенизированной водоросли, иногда за счет дополнительных слоев. Основное отличие проявляется в структуре хлоропласта: тилакоидные пучки становятся толще, разветвлены меньше и уложены плотнее. Пластоглобулы немногочисленны. Крахмальных зерен мало, и они невелики.
Рис.2. Ультраструктура клетки Trebouxia в фотоавтотрофных условиях (на свету, на минеральной среде). Кс - клеточная стенка, Кр - крахмальное зерно, Лк - липидная капля, Хл - хлоропласт, Я - ядро, Мт - митохондрия.
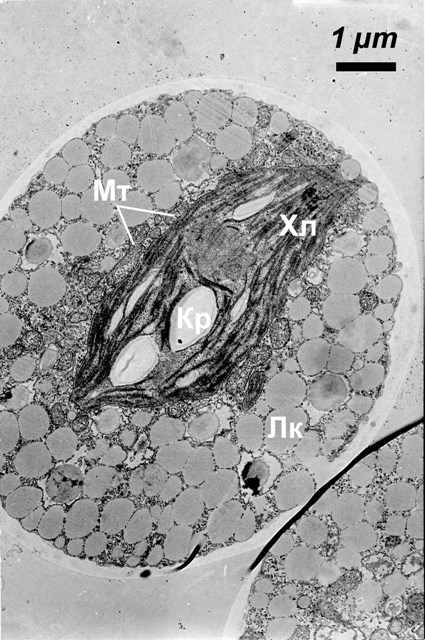
При миксотрофном росте, на среде 2 с глюкозой при освещении (рис.3), клеточная стенка водоросли становится более электронно-прозрачной, чем в предыдущих вариантах; плазмалемма более извилиста. Митохондрии довольно многочисленны. Хлоропласт уменьшается, пучки тилакоидов в нем расположены реже, между ними наблюдаются крахмальные зерна, как мелкие, так и значительно более крупные, чем в лихенизированной водоросли и на среде 1. Пластоглобул мало. Количество пиреноглобул в пиреноиде уменьшено, и они располагаются по его периферии. Липидные включения в цитоплазме многочисленны, как и в предыдущих вариантах. В некоторых вакуолях откладывается хлопьевидный материал.
Рис.3. Ультраструктура клетки Trebouxia в миксотрофных условиях (на свету, на минерально-органической среде с глюкозой). Мт - митохондрия, Хл - хлоропласт, Кр - крахмальное зерно, Лк - липидная капля.
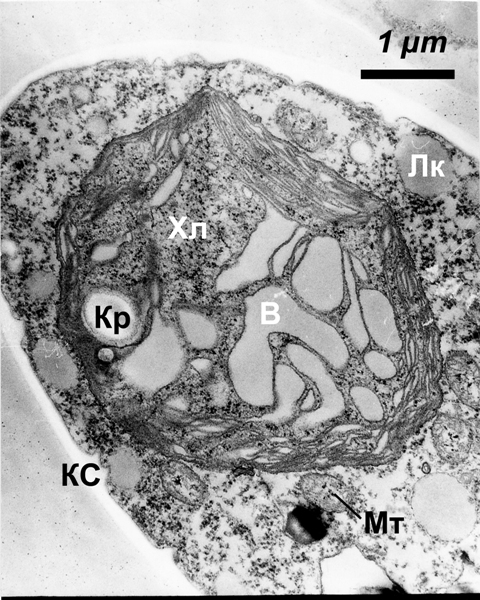
При повышении степени гетеротрофности в условиях миксотрофного питания, на среде 3 с глюкозой, пептоном и дрожжевым экстрактом при освещении, ультраструктура Trebouxia близка к таковой на среде 2, но величина хлоропласта и количество тилакоидов в нем еще меньше, пластоглобул мало; пиреноглобул в пиреноиде также немного, и они распределяются по периферии. Число митохондрий возрастает, и форма некоторых из них становится более вытянутой и неправильной. В вакуолях встречаются объемные осмиофильные включения. Особенно существенно изменяется ультраструктурная организация клетки Trebouxia при выращивании на среде 3 в темноте, в условиях гетеротрофного питания (рис.4). Клеточная стенка водоросли становится более тонкой, а плазмалемма – извилистой, с инвагинациями – местами в клеточную стенку, местами в цитоплазму. Цитоплазма разрежена, с меньшим количеством рибосом; липидных капель в цитоплазме мало. В вакуолях присутствуют крупные осмиофильные включения округлой или неправильной формы и везикулы. Часть митохондрий имеют вид конденсированных, с небольшим количеством трубчатых крист.
Рис.4. Ультраструктура фикобионта Trebouxia в гетеротрофных условиях (в темноте, на минерально-органической среде с глюкозой, пептоном и дрожжевым экстрактом). Лк - липидная капля, Хл - хлоропласт, Кр - крахмальное зерно, В - вакуоль, Кс - клеточная стенка, Мт - митохондрия.
Мембранная система хлоропласта водоросли претерпевает значительную редукцию. Количество тилакоидов в нем уменьшено, пучки тилакоидов часто включают не более двух, а расстояние между ними увеличено. Большая часть объема хлоропласта занята крупными крахмальными зернами, которые иногда отделяются друг от друга единственным тилакоидом. В хлоропласте встречаются лишь отдельные пластоглобулы, но имеются крупные включения неправильной формы, вероятно, также липидной природы, но небольшой электронной плотности. Возможно, они происходят из разрушившихся тилакоидных мембран. В пиреноиде небольшое количество периферийно расположенных пиреноглобул. В гетеротрофных культурах зеленых водорослей нередко отмечается не только уменьшение количества пиреноглобул и перемещение их к периферии, но и значительная редукция самого пиреноида вплоть до полного его исчезновения (Владимирова, 1976; Сытник и др., 1984). Наблюдаемые ультраструктурные изменения клетки могут произвести впечатление деструктивных, Но эти модификации отличаются от дегенеративных изменений, наблюдавшихся нами и другими исследователями у Trebouxia в талломах H. physodes при загрязнении воздуха SO2 и тяжелыми металлами: (Власова, Жевлачкова, 2008; Holopainen, 1982; Holopainen, Kärenlampi, 1984), когда происходят явные повреждения мембранной системы хлоропластов и других клеточных структур. Обнаруженные нами изменения указывают на явную редукцию фотосинтетического аппарата, что согласуется с данными о значительной потере фотосинтетических пигментов у Trebouxia erici при выращивании в темноте на органической среде (Fox, 1967). Это предполагает снижение фотосинтетической активности водоросли. Однако показано, что многие зелёные фотобионты способны к росту на органических средах при полном отсутствии света (Ahmadjian, 1993). В частности, многие виды Trebouxia способны расти гетеротрофно, причем некоторые из них одинаково успешно культивируются на свету и в темноте (Archibald, 1977). Более того, было показано, что гетеротрофный рост трех видов Trebouxia на среде с глюкозой и гидролизатами аминокислот происходил даже интенсивнее, чем рост фотосинтетический, автотрофный (Fox, 1967). При искусственном синтезе лишайников фотобионт Trebouxia в смешанных культурах также был способен в течение нескольких месяцев успешно существовать в темноте (Ahmadjian, Jacobs, 1987). Эти данные наряду с наблюдениями над антарктическими лишайниками, способными выживать в течение большей части года под глубоким снежным покровом, привели к заключению, что Trebouxia в составе лишайникового таллома может осуществлять гетеротрофный обмен. Однако наши наблюдения в данном случае указывают на большее ультраструктурное и, вероятно, функциональное сходство Trebouxia в талломе с автотрофной культурой. Изменения ультраструктуры Trebouxia при культивировании на средах различного состава и в различных условиях освещения были во многом сходны с субмикроскопическими изменениями в клетках Coccomyxa в аналогичных условиях. Кроме того, характеристики Coccomyxa в талломе и при различных условиях культивирования сопоставляли с результатами определений газообмена у различных культур фикобионта. Это позволило с высокой степенью вероятности сделать вывод о преобладании автотрофного обмена у Coccomyxa в талломе лишайника, во всяком случае, в определенных условиях (Власова и др., 1991). Результаты наблюдений позволяют заключить, что пластичность ультраструктуры фикобионта, свойственная многим одноклеточным водорослям, указывает на его метаболическую пластичность и подвижность, что содействует выживанию самого фикобионта и всего лишайника в меняющихся условиях внешней среды и, вероятно, во многом обеспечивает способность лишайников существовать в самых суровых условиях. Таким образом, изменения ультраструктуры фикобионтов, отражающие сдвиги метаболизма, могут рассматриваться как адаптивные преобразования.
1. Болдина О.Н. Морфологические типы организации пиреноидов у зеленых монад // Вестник ТвГУ, сер. Биология и экология. 2008. Вып. 9. С. 21-25. 2. Брунь Г.А. Макромолекулярная систематика лишайников. Достижения и перспективы развития. // Актуальные проблемы экспериментальной лихенологии в СССР. / Под ред. Н.С. Голубковой. Л., 1991. Вып. 1. С. 12-21. 3. Вайнштейн Е.А., Тахтаджян Е.А. Физиологические изменения у лишайниковой водоросли Trebouxia при культивировании // Физиол. раст. 1981.Т.28, №5. С.1037-1044. 4. Владимирова М.Г. Изменения ультраструктурной организации при функциональных перестройках клетки Chlorella sp. K // Физиология растений. 1976. 23, вып. 6. С. 1180-1187. 5. Власова Т.А., Гордонова И.К., Плакунова В.Г. Варьирование ультраструктуры Coccomyxa – фотобионта лишайника Peltigera aphthosa в зависимости от условий существования // Актуальные проблемы экспериментальной лихенологии в СССР. / Под ред. Н.С. Голубковой. Л., 1991. Вып. 1. С. 66-73. 6. Власова Т.А., Жевлачкова И.К. Влияние абиотического стресса на ультраструктуру зеленой водоросли Trebouxia, фикобионта лишайника Hypogymnia physodes // Физико-химические основы структурно-функциональной организации растений. Годичное собрание ОФР России, Екатеринбург 6 - 10 октября 2008 г. Тезисы докладов Международной научной конференции. - С. 111 -112. 7. Войцехович А.А., Михайлюк Т.И., Дариенко Т.М. Фотобионты лишайников. 1: разнообразие, экологические особенности, взаимоотношения и пути совместной эволюции с микобионтом // Альгология. 2011. 21, №1. С. 3-26. 8. Лобакова Е.С., Смирнов И.А. Экспериментальная лихенология // Журнал общей биологии. 2008. 69, №3. С. 364-378. 9. Плакунова В.Г., Власова Т.А. Ультраструктурные изменения при обратимой делихенизации компонентов лишайника Peltigera aphthosa // Изв. АН СССР. Сер. биол. 1985. № 3. С. 345-351. 10. Равинская А.П. Включение С14 в лишайниковые кислоты при фотосинтезе // Физиология растений. 1975. 22, вып.2. С.251-255. 11. Сытник К.М., Кордюм Е.Л., Недуха Е.М., Сидоренко П.Г., Фомичева В.М. Растительная клетка при изменении геофизических факторов. Киев: Наукова думка, 1984. 136 с. 12. Ahmadjian,V. Symbiont interactions / The lichens. Eds. Ahmadjian V., Hale M.E. New York, London, 1973. 249p. 13. Ahmadjian V. The lichen symbiosis. John Wiley & Sons, Inc. New York. 1993. 266 p. 14. Ahmadjian, V., Jacobs J.B. Studies on the development of synthetic lichens. In Progress and problems in lichenology in the eighties // Bibliotheca Lichenologica. 1987. 25. P.47-58. 15. Archibald P.A. Trebouxia de Puymaly (Chlorophyceae, Chlorococcales) and Pseudotrebouxia gen. nov. (Chlorophyceae, Chlorococcales) // Phycologia. 1975. 14. P. 125–137. 16. Archibald P.A. Physiological characteristics of Trebouxia (Chlorophyceae, Chlorococcales) and Pseudotrebouxia (Chlorophyceae, Chlorosarcinales) // Phycologia. 1977. 16, 3. P. 295-300. 17. Ascaso C. Ultrastructural modifications in lichens induced by environmental humidity // Lichenologist. 1978. 10. P.209-219. 18. Ascaso C., Valladares F., De los Rios A.. New ultrastructurel aspects of pyrenoids of the lichen photobiont Trebouxia (Microthamniales, Chlorophyta) // J. Phycol. 1995. 31. P. 114–119.. 19. Brunauer G., Stocker-Wörgötter E. Culture of lichen fungi for future production of biologically active compounds // Symbiosis. 2005. 38, №2. P.187-201. 20. Brunner U., Honegger R. Chemical and ultrastuctural studies on the distribution of sporopo lleninlike biopolymers in six genera of lichen phycobionts // Can. J. Bot. 1985. 63. P. 2221–2230. 21. Fox C.H. Studies of the cultural physiology of the lichen alga Trebouxia // Physiol. Plantarum. 1967. 20, №1. P. 251-262. 22. Friedl T, Büdel B. Photobionts / Lichen Biology. Ed. Nash III, T.H. Cambridge: Cambridge University Press, 1966. P. 8-23. 23. Gärtner G., Ingoliċ E. Zur Morphologie und Systematik des Trebouxia-Phycobionthen im Thallus von Usnea longissima (Lecanorales) // Pl. Syst. Evol. 1988. 158. 19. P. 225-234 24. GreenT. G., Smith D.C. Lichen physiology. XIY. Differences between lichen algae in symbiosis and isolation // New Phytol. 1974. 73, №4. P.753-766. 25. Hale M.E. The biology of lichens / 3d ed., Edward Arnold (Publ.) Ltd: London, 1983. 190 p. 26. Holopainen T. Comparision of the ultrastructural changes in epyphitic lichens at different distances from two industrial pollution sources // Savonia. 1982. 5. P.15-30. 27. Holopainen T.,Kärenlampi L. Injuries to lichen ultrastructure caused by sulphur dioxide fumigations // New Phytol. 1984. 98, №2. P.285-294. 28. Kershaw K.A.. Seasonal photosynthetic capacity changes in lichens: a provisional mechanistic interpretation // Lichenologist. 1984. 16, №2. P.145-171. 29. König J., Peveling E. Cell walls of the phycobionts Trebouxia and Pseudotrebouxia: constituents and their location // Lichenologist. 1984. 16. P.129–144. 30. Miao V.P.W., Rabenau A.., Lee A. Cultural and molecular characterization of photobionts of Peltigera membranacea // Lichenologist. 1997. 29. P.571-586. 31. Peveling E., König J. Differences in formation of vegetative cells and their walls in Trebouxia and Pseudotrebouxia as further evidence for the classification of these genera // Lichenologist. 1985. 17, 3. P. 281-287. 32. Reynolds E.S. The use of lead citrate at high ph as an electronopaque stain in electron microscopy // J.Cell Biol. 1963. V.17. P. 208-212. 33. Stocker-WörgötterE., Türk R. Laborversuche zur Kultivierung von Blatt - und Strauchflechten und deren Komponenten // Nova Hedvigia. 1989. 48, №1-2. S.207-228. опубликовано - декабрь 2012 г.
Effect of cultural conditions on ultrastructure of green alga Trebouxia, phycobiont of lichen Hypogymnia physodes The green alga Trebouxia, phycobiont of epiphytic foliose lichen Hypogymnia physodes, was isolated from the lichen and cultivated in the different media and in the different light conditions . The ultrastructure of algal cells varied widely depending on the cultural conditions. The autotrophic culture of the alga showed the maximal similarity to the phycobiont in the lichen thallus. The most variations might be considered as adaptive ones. Key words: lichens; phycobionts; Hypogymnia physodes; Trebouxia; electron microscopy; ultrastructure; adaptation.
Об авторах Власова Татьяна Анатольевна - Tatyana A. Vlasova кандидат биологических наук tat_vla@list.ru Жевлачкова Ирина Константиновна - Irina K. Zhevlachkova zhev@mail.ru ФГБОУ ВПО «Московский государственный университет им.М.В.Ломоносова», Москва, Россия (Lomonosov Moscow State University, Moscow, Russia), биологический ф-т, каф. физиологии растений Корреспондентский адрес: Россия, 119991, Москва, Ленинские горы, Московский Государственный Университет им.М.В.Ломоносова, д. 1, стр. 12, Биологический ф-т, каф. физиологии растений; тел.: (495) 939-21-18
ССЫЛКА НА СТАТЬЮ: Власова Т.А., Жевлачкова И.К. Влияние условий культивирования на ультраструктуру зеленой водоросли Trebouxia, фикобионта лишайника Hypogymnia physodes // Вопросы современной альгологии. 2012. № 2 (2). URL: http://algology.ru/146

|
|||
| |||